Steatosi Epatica Non Alcolica
La Steatosi Epatica ha come moderna denominazione l’interpretazione di un acronimo anglosassone utilizzato in medicina: NAFLD, vale a dire malattia del fegato grasso non alcolica. La NAFLD è caratterizzata da accumulo di grasso intraepatico quando non è possibile identificare altre cause di accumulo secondario (ad esempio, un consumo eccessivo di alcol). La NAFLD va dalla condizione più benigna di fegato grasso non alcolico (NAFL) alla steatoepatite non alcolica (NASH), che si colloca all'estremità più grave dello spettro.
La NAFLD può progredire verso la fibrosi e la cirrosi.
La NAFLD è definita come steatosi con
- un'infiltrazione di grasso ≥5% nella diagnostica per immagini o nell'istologia e
- assenza di steatosi indotta da alcol, farmaci o virus.
I pazienti con NAFLD possono presentare enzimi epatici elevati.
Nella NAFLD, la steatosi epatica è presente senza evidenza di infiammazione, mentre nella NASH, la steatosi epatica è associata a infiammazione lobulare e apoptosi che possono portare a fibrosi e cirrosi.
Da dati di studi su popolazione generale, circa il 25% degli Italiani tra 18 e 65 anni di età sarebbe affetto da NAFLD. Complessivamente, la prevalenza stimata della NAFLD nella popolazione generale si attesta intorno al 20-40%, ma è maggiore negli obesi e nei diabetici. La NASH rappresenta circa il 20% delle NAFLD (prevalenza stimata pari al 2-3% nella popolazione generale) ed è indicata come la causa dell’80% delle cirrosi criptogenetiche. Nell’area mediterranea, la NAFLD è più frequente negli uomini nella terza e quarta decade di vita (70% dei casi) rispetto alle donne, ma la protezione del sesso femminile viene persa dopo l’insorgenza della menopausa.
I pazienti con NAFLD spesso rivelano uno o più componenti della sindrome metabolica (SM) come:
- ipertensione sistemica
- dislipidemia
- insulino-resistenza o diabete manifesto.
È sempre più evidente che l'obesità viscerale è un fattore di rischio per la NAFLD e bisogna anche considerare che la SM è un noto fattore di rischio per lo sviluppo di malattie cardiovascolari. Nel luglio 2020, una consensus di esperti ha proposto di superare l'attuale nomenclatura "NAFLD" e di adottare l'acronimo Metabolic dysfunction-Associated Fatty Liver Disease (MAFLD) utilizzando le disfunzioni metaboliche o la SM come criteri diagnostici, indipendentemente dalla presenza di altre cause di malattia epatica.
Si ritiene che l'insulino-resistenza sia un fattore comune nella patogenesi che collega entrambe le entità.
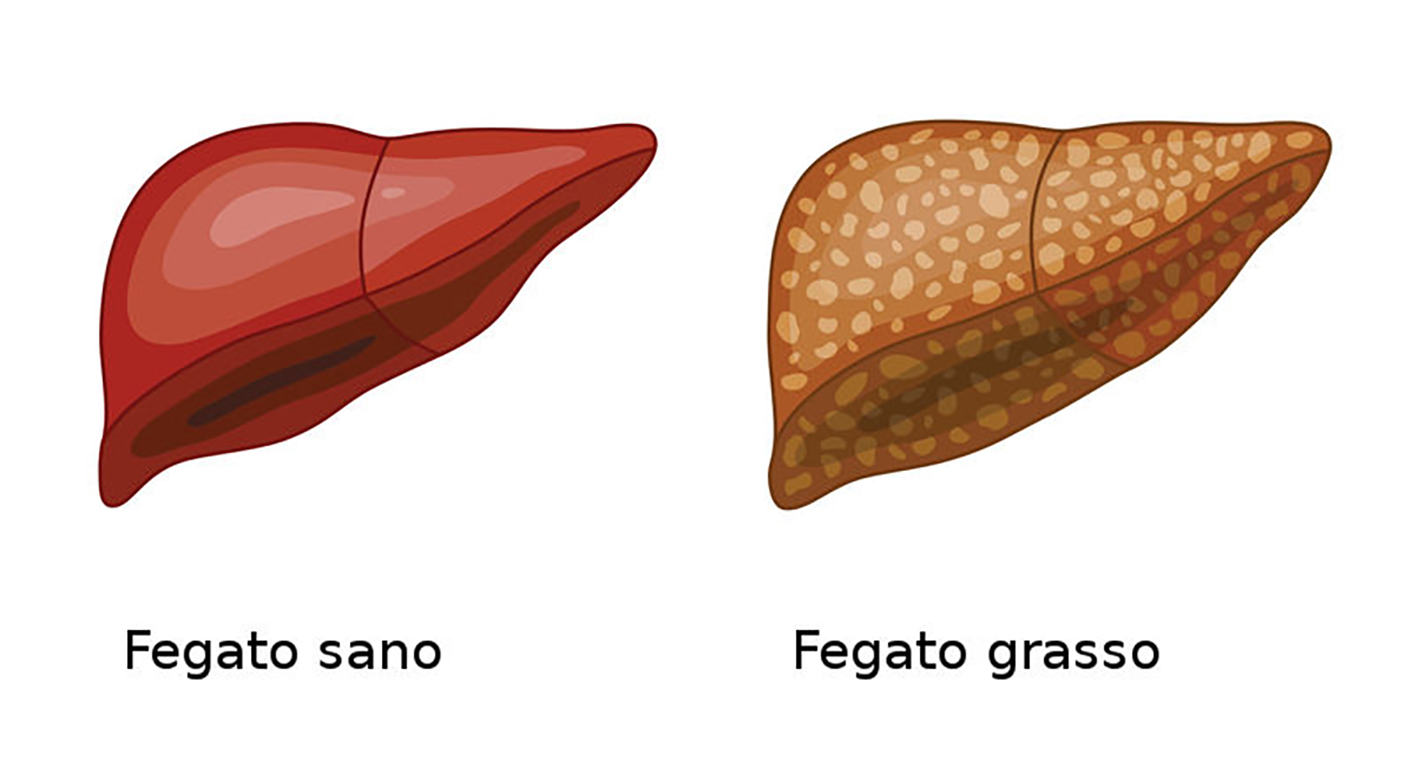
Immagine: https://www.epac.it/cm-files/img/2022/10/12/fotolia-37322590-s-b.jpg
Lo sviluppo della NASH è un processo articolato e non pienamente compreso. Negli ultimi anni sono stati condotti molti studi su animali per comprendere la fisiopatologia della NAFLD e della NASH, principalmente con modelli dietetici diversi (dieta ad alto contenuto di fruttosio, ad alto contenuto di grassi o con carenza di metionina e colina (MCD). Basandosi su questi dati, è stato suggerito che lo sviluppo della NASH sia un processo a due fasi. La prima fase di questo processo è il deposito di grasso nel fegato che aumenta la resistenza all'insulina. La seconda parte di questo processo è costituita da mutamenti cellulari e molecolari che includono lo stress ossidativo e l'ossidazione degli acidi grassi nel fegato a causa di una serie di fattori (danno da citochine, iperinsulinemia, ferro epatico e/o perossidazione lipidica, variazione della matrice extracellulare, omeostasi energetica e cambiamenti nella funzione del sistema immunitario).
Lo sviluppo dell'insulino-resistenza è un processo complicato. Nel contesto della SM, come nel caso di molti pazienti con NASH, l'aumento della massa grassa e la differenziazione degli adipociti giocano un ruolo sostanziale nello sviluppo dell'insulino-resistenza. Un bilanciamento energetico pendente verso l’accumulo di grassi causato da un elevato introito calorico e scarso consumo, rende ragione del deposito di gocciole di trigliceridi nel parenchima epatico.
La NAFLD può essere suddivisa in due tipi distinti:
- il primo tipo ha una stretta relazione con la sindrome metabolica e le attuali convinzioni sono che l'insulino-resistenza sia il meccanismo fisiopatologico primario,
- Il secondo tipo ha una relazione con le patologie infettive che possono condurre alla comparsa di steatosi epatica. In questo caso, infezioni come l'epatite C e l'HIV possono essere una causa, ma è anche associata a farmaci (nutrizione parenterale totale, glucocorticoidi, tamoxifene, tetraciclina, amiodarone, metotrexato, acido valproico, cloruro di vinile) e a tossine specifiche o a malattie metaboliche ereditarie/acquisite (ad esempio, lipodistrofia o cachessia o interventi di bypass intestinale).
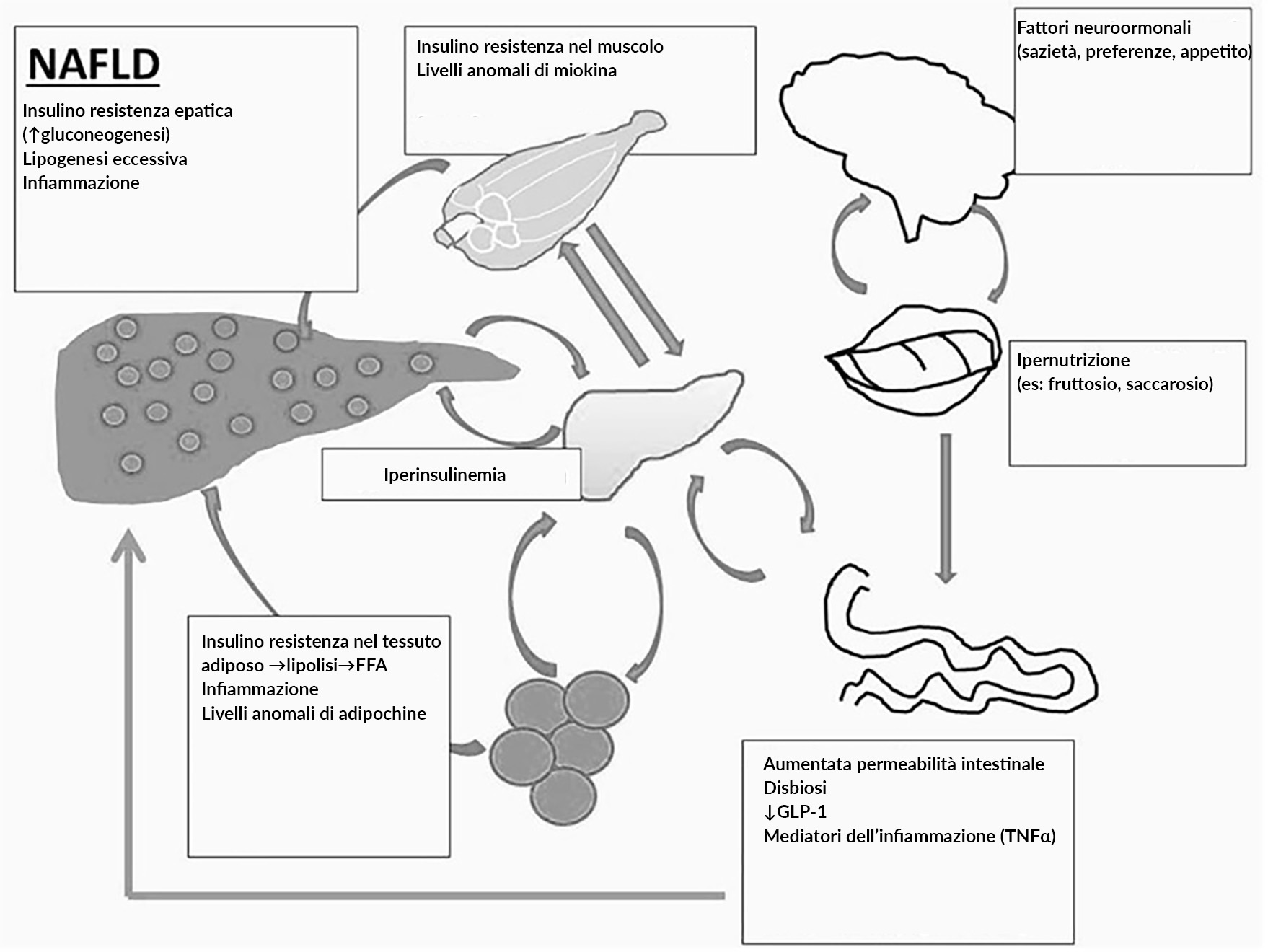
FFA= Acidi Grassi Liberi
GLP-1= Glucagon-Like Peptide 1 (peptide-1 simile al glucagone)
TNFα= Tumor Necrosis Factor α (Fattore di Necrosi Tumorale α)
Fattori di rischio e presentazione
Le persone affette da NAFLD presentano usualmente le caratteristiche della SM, con i connessi fattori di rischio per le malattie cardiovascolari. Nella NAFLD l'obesità, il diabete mellito di tipo 2 (T2DM) e la dislipidemia sono considerati importanti fattori di rischio. Alcuni studi hanno dimostrato una maggiore prevalenza di malattie cardiovascolari (CVD) nei pazienti con NAFLD, senza e con diabete. Pertanto, la NAFLD è solitamente associata a uno stile di vita non sano, con evidenze che suggeriscono che la modifica di tali stili di vita può migliorare la NAFLD. Uno studio su pazienti con T2DM ha rilevato una maggiore prevalenza di malattie vascolari periferiche maggiori, coronariche, cerebrovascolari, tra i soggetti con NAFLD rispetto a quelli senza, a prescindere dai normali fattori di rischio CVD, dall'uso di farmaci e dalle variabili legate al diabete.
La relazione tra NAFLD e fumo è controversa. Una revisione sistematica e una meta-analisi di 20 studi pubblicati hanno rilevato che il fumo è fortemente associato alla NAFLD. Uno studio trasversale su 933 pazienti (368 fumatori e 565 non fumatori) non ha riscontrato alcuna differenza nella prevalenza della NAFLD nei due gruppi (22,2% contro 29%), né nei forti fumatori (> 20 pacchetti di sigarette all'anno).
La maggioranza dei pazienti con NAFLD non presenta alcun sintomo, tuttavia alcuni di loro possono lamentare affaticamento, fastidio epigatrico destro, epatomegalia, acanthosis nigricans e lipomatosi. In circa il 48-100% dei casi la NASH è quindi asintomatica e molto spesso viene scoperta durante screening medico per altri motivi. Tuttavia, uno studio ha dimostrato che al momento della diagnosi la splenomegalia era presente nel 25% dei pazienti. Molto spesso una diagnosi come NASH o NAFLD viene scoperta a causa di test di funzionalità epatica anomali come le aminotransferasi (ALT e AST) o del riscontro occasionale di steatosi epatica all'esame radiologico. L'epatomegalia può presentarsi all'esame fisico ed è causata dall'infiltrazione grassa del fegato.
Durante l'esecuzione degli esami di laboratorio, i marcatori sierici come le aminotransferasi (AST, ALT) sono da lieve a moderatamente elevati. Tuttavia, i livelli di AST e ALT possono essere aspecifici nei pazienti con NAFLD o condizioni correlate. Nei pazienti con NAFLD, i livelli anomali di ALT sono più comuni di quelli di AST. I livelli di ALT tendono a essere più elevati nella NASH che nella steatosi semplice. I livelli di ferritina sierica sono comunemente elevati nei pazienti con NAFLD e l'aumento della saturazione della transferrina si riscontra nel 6-11% dei pazienti. Altri marcatori di interesse sono la fosfatasi alcalina (ALP) e i fattori di coagulazione. Nei pazienti con NAFLD l'ALP può essere anormale e persino elevata 2-3 volte il limite superiore del suo valore normale. Inoltre, altri valori di laboratorio possono essere utili per la diagnosi di NAFLD. I livelli di albumina e bilirubina possono essere elevati nei pazienti che hanno sviluppato una malattia cronica progressiva.
La diagnostica per immagini viene in notevole ausilio per il riconoscimento della malattia.
L’ecografia spesso rivela una struttura iperecogena o un fegato luminoso a causa dell'infiltrazione grassa diffusa. La sensibilità e la specificità degli ultrasuoni sono rispettivamente dell'89 e del 93% nel rilevare l'aumento della fibrosi e della steatosi.
TC e RM sono in grado di rilevare la steatosi, ma mancano di sensibilità per individuare i processi infiammatori o fibrotici del fegato.
La biopsia epatica è il gold standard per la diagnosi di NASH o NAFLD. Essa è in grado di confermare o escludere la diagnosi. È comunque sempre opportuno effettuare una diagnosi preventiva soprattutto in base all'anamnesi, agli esami di laboratorio e alla diagnostica per immagini. La biopsia epatica può essere molto utile per valutare l'entità del danno epatico in generale, ma anche nei pazienti che rimangono con una diagnosi non chiara dopo valutazioni non invasive. I limiti della biopsia epatica sono quelli comuni: la variabilità dell'errore di campionamento, la variabilità inter- e intra-osservatore e il rischio di complicanze.
Il NAFLD Activity Score (NAS) è un punteggio internazionalmente validato impiegato per classificare l'attività della malattia nei pazienti con NAFLD. Il NAS ha diverse componenti e ciascuna di esse ha un punteggio minimo e massimo: steatosi (da 0 a 3), infiammazione lobulare (da 0 a 3), palloncino epatocellulare (da 0 a 2). La fibrosi non è inclusa nel NAS.
Nello studio originale che ha generato il NAS, i punteggi:
- da 0 a 2 si sono verificati nei casi considerati principalmente non diagnostici di NASH;
- da 3 a 4 sono stati equamente suddivisi tra quelli considerati non diagnostici, borderline o positivi per NASH;
- da 5 a 8 si sono verificati nei casi considerati principalmente diagnostici di NASH.
Trattamento
Il trattamento della NAFLD e delle malattie connesse consiste in diversi livelli, di cui le terapie conservative e chirurgiche sono trattamenti noti. Nella quasi totalità dei casi il trattamento dei pazienti con NAFLD consta in un intervento mirato a più aspetti, come la perdita di peso, la modifica dello stile di vita e l'eventuale ottimizzazione dei farmaci.
Ad oggi non esiste un trattamento farmacologico specifico per la NAFLD, tuttavia si ritiene che una combinazione di obiettivi terapeutici (aggiustamenti dello stile di vita, aumento dell'attività fisica e cessazione del fumo/alcol) possa essere utile.
Appare fondamentale la riduzione dell'apporto calorico e degli alimenti ad alto indice glicemico (IG), l'aumento del consumo di acidi grassi monoinsaturi, di acidi grassi omega-3, di fibre e di fonti proteiche specifiche come il pesce e il pollame, abbia effetti benefici. Una dieta mediterranea può ridurre il grasso epatico e quindi contribuire positivamente alla gestione della NAFLD. Il consumo prolungato di bevande zuccherate ha una correlazione positiva con la NAFLD. Si suggerisce che una dieta ad alto contenuto proteico sia benefica per la gestione della NAFLD, ma la fonte proteica deve essere considerata alla luce dell'evidenza del consumo di carne rossa sulla malattia cardiovascolare e della considerazione delle proteine in una dieta vegetariana. Anche altri costituenti dell’alimentazione possono risultare utili nel trattamento della NAFLD, come l’assunzione di vitamina E (antiossidante), caffeina e polifenoli.
La caffeina è un forte antiossidante che potrebbe contribuire a ridurre il carico dello stress ossidativo e dell'infiammazione nel fegato e potrebbe fornire un effetto epatoprotettivo. Molti studi hanno collegato il consumo di caffè a un miglioramento degli enzimi epatici in modo dose-dipendente in soggetti a rischio di malattie epatiche. Secondo uno studio di meta-analisi, il consumo di più di 3 tazze di caffè al giorno, ma non meno di 2, ha un evidente ruolo protettivo.
I polifenoli sono una classe eterogenea di composti di origine vegetale che comprende diversi antiossidanti idrosolubili segnalati come agenti di promozione della salute e proposti nel trattamento di diversi disturbi metabolici. I polifenoli naturali sono presenti in natura e in particolare sono stati trovati in quantità elevate in molti alimenti e piante, come verdure, frutta, cereali, spezie, funghi, tè, microalghe, piante medicinali, frutti selvatici e fiori. Esiste una notevole quantità di prove che indicano gli effetti epatoprotettivi di queste biomolecole.
Conclusioni
La NAFLD è una malattia sistemica e diversificata, con presentazioni e decorso variabili intimamente legati a T2D e CVD.
La progressione della malattia è determinata dalla complessa interazione di una serie di fattori, tra cui quelli ambientali (dieta, esercizio fisico), il microbioma e i fattori epigenetici e genetici che determinano cambiamenti metabolici, infiammatori e fibrotici. La presentazione eterogenea della malattia identifica sottogruppi di pazienti attraverso il profilo della composizione corporea, altri metodi di fenotipizzazione e di genotipizzazione. L'identificazione di sottogruppi di pazienti dovrebbe consentire la possibilità di terapie peculiari per pazienti e/o fattori patologici.
L'inacapacità di gestire il sovraccarico di FFA dal punto di vista biochimico, l'inflessibilità metabolica, ovvero l’incapacità di mutare il substrato energetico (acidi grassi e carboidrati) in base alle condizioni metaboliche, allo stato fisico e alle risorse dei nutrienti, rappresenta il nucleo centrale della patogenesi della NAFLD. La lipotossicità che ne deriva, la disfunzione mitocondriale e stress cellulare in più organi e tessuti portano ad infiammazione, apoptosi, fibrogenesi e, infine, alla progressione da NAFL a NASH.
Per tutto ciò, terapie efficaci e durature richiederanno verosimilmente di affrontare i fattori metabolici sostanziali della NAFLD (insulino-resistenza, incapacità di processare gli FFA in eccesso, disfunzione mitocondriale) e lo stress lipotossico e il danno ossidativo che ne derivano, e simultaneamente altre caratteristiche più a valle, come il danno cellulare e la fibrosi, per ristabilire le risposte riparative adattive alla lipotossicità cronica.
NOTE BIBLIOGRAFICHE
Pouwels, S et al.
Non-alcoholic fatty liver disease (NAFLD): a review of pathophysiology, clinical management and effects of weight loss.
BMC Endocr Disord 22, 63 (2022). https://doi.org/10.1186/s12902-022-00980-1Ahmed A, et al.:
Nonalcoholic fatty liver disease review: diagnosis, treatment, and outcomes.
Clin Gastroenterol Hepatol. 2015;13(12):2062–70.Machado MV, Diehl AM.
Pathogenesis of nonalcoholic Steatohepatitis. Gastroenterology.
2016;150(8):1769–77Younossi Z, et al.
Global burden of NAFLD and NASH: trends, predictions, risk factors and prevention.
Nat Rev Gastroenterol Hepatol. 2018;15(1):11–20.https://www.simg.it/Riviste/rivista_simg/2016/01_2016/4.pdf
Dixon JB, Bhathal PS, O’Brien PE.
Nonalcoholic fatty liver disease: predictors of nonalcoholic steatohepatitis and liver fibrosis in the severely obese.
Gastroenterology. 2001;121(1):91–100.Lau JK, Zhang X, Yu J.
Animal models of non-alcoholic fatty liver disease: current perspectives and recent advances.
J Pathol. 2017;241(1):36–44.Day CP, Saksena S.
Non-alcoholic steatohepatitis: definitions and pathogenesis.
J Gastroenterol Hepatol. 2002;17(Suppl 3):S377–84Eslam M, Newsome PN,
A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement.
J Hepatol. 2020 Jul;73(1):202-209.Byrne CD, Targher G.
NAFLD: a multisystem disease.
J Hepatol. 2015;62(1):S47–64.Anstee QM, Targher G, Day CP.
Progression of NAFLD to diabetes mellitus, cardiovascular disease or cirrhosis.
Nat Rev Gastroenterol Hepatol. 2013;10(6):330–44.EASL. EASD&EASO clinical practice guidelines for the management of non-alcoholic fatty liver disease.
J Hepatol. 2016;64(6):1388–402.Targher G, Day CP, Bonora E.
Risk of cardiovascular disease in patients with nonalcoholic fatty liver disease.
N Engl J Med. 2010;363(14):1341–50.Targher G,et al.
Prevalence of nonalcoholic fatty liver disease and its association with cardiovascular disease among type 2 diabetic patients.
Diabetes Care. 2007;30(5):1212–8.Al-Dayyat HM, et al.:
Non-alcoholic fatty liver disease and associated dietary and lifestyle risk factors.
Diabetes Metab Syndr. 2018;12(4):569–75.Chavez-Tapia NC, et al.:
Smoking is not associated with nonalcoholic fatty liver disease.
World J Gastroenterol. 2006;12(32):5196–200.Charatcharoenwitthaya P, et al.
The spontaneous course of liver enzymes and its correlation in nonalcoholic fatty liver disease.
Dig Dis Sci. 2012;57(7):1925–31.Mofrad P. et al.
Clinical and histologic spectrum of nonalcoholic fatty liver disease associated with normal ALT values.
Hepatology (Baltimore, Md). 2003;37(6):1286–92.Hernaez R, et al.
Diagnostic accuracy and reliability of ultrasonography for the detection of fatty liver: a meta-analysis.
Hepatology (Baltimore, Md). 2011;54(3):1082–90.de Moura AA, et al.
Fatty liver disease in severe obese patients: diagnostic value of abdominal ultrasound.
World J Gastroenterol. 2008;14(9):1415–8.Adams LA, Talwalkar JA.
Diagnostic evaluation of nonalcoholic fatty liver disease.
J Clin Gastroenterol. 2006;40(Suppl 1):S34–8Merriman RB, et al.
Correlation of paired liver biopsies in morbidly obese patients with suspected nonalcoholic fatty liver disease.
Hepatology (Baltimore, Md). 2006;44(4):874–80.Ratziu V, et al.
Sampling variability of liver biopsy in nonalcoholic fatty liver disease.
Gastroenterology. 2005;128(7):1898–906.Kleiner DE, et al.
Design and validation of a histological scoring system for nonalcoholic fatty liver disease.
Hepatology (Baltimore, Md). 2005;41(6):1313–21.Pintó X, et al.
A Mediterranean diet rich in extra-virgin olive oil is associated with a reduced prevalence of nonalcoholic fatty liver disease in older individuals at high cardiovascular risk.
J Nutr. 2019;149(11):1920–9.Chen YP, et al.
A systematic review and a dose-response meta-analysis of coffee dose and nonalcoholic fatty liver disease.
Clin Nutr (Edinburgh, Scotland). 2019;38(6):2552–7.Abenavoli L, et al.
Polyphenols treatment in patients with nonalcoholic fatty liver disease.
J Transl Intern Med. 2017;5(3):144–7.Li S, et al.
The potential and action mechanism of polyphenols in the treatment of liver diseases.
Oxidative Med Cell Longev. 2018;2018:8394818.SISTEMA NAZIONALE LINEE GUIDA DELL’ISTITUTO SUPERIORE DI SANITÀ
Steatosi epatica non alcolica. Linee guida per la pratica clinica dell’Associazione Italiana per lo Studio del Fegato (AISF),
Società Italiana di Diabetologia (SID) e Società Italiana dell’Obesità (SIO).
Linea guida pubblicata nel Sistema Nazionale Linee Guida. Roma, 18 marzo 2022.
https://www.iss.it/-/snlg-steatosi-epatica-non-alcolicaCarr RM, et al.
Nonalcoholic Fatty Liver Disease: Pathophysiology and Management.
Gastroenterol Clin North Am. 2016 Dec;45(4):639-652. doi: 10.1016/j.gtc.2016.07.003. Epub 2016 Oct 13.



