Microbiota e funzionalità epatica
La comprensione delle connessioni tra microbioma intestinale (GM) e fegato ha fornito importanti ed approfondite conoscenze sulla fisiopatologia delle malattie epatiche.
La disbiosi microbica intestinale accentua la permeabilità della parete enterica
- i metaboliti biosintetizzati dai microrganismi atipici possono raggiungere il fegato attraverso la circolazione portale ed influenzare l'immunità e l'infiammazione epatica
- le cellule immunitarie attivate da questi metaboliti possono raggiungere il fegato anche attraverso la circolazione linfatica
Il fegato influenza l'immunità e il metabolismo di più organi del corpo, compreso l'intestino. Rilascia gli acidi biliari e altri metaboliti nelle vie biliari, da dove si immettono nel circolo sistemico. Analizziamo ora la comunicazione bidirezionale tra l'intestino e il fegato e il cross talk molecolare tra l'ospite e il microbioma. Esiste inoltre un livello di comunicazione ed un ruolo del microbioma negli assi intestino-fegato-cervello, intestino-fegato-rene, intestino-fegato-polmone e intestino-fegato-cuore. Queste osservazioni indicano una complessa rete di interazioni tra i vari organi (multiorgano) dell'ospite influenzate dal GM.
L’ asse intestino-fegato ha dei suoi proprii meccanismi di comunicazione, su alcuni ancora ci sarà molto da studiare e chiarire, ad oggi è stato certamente dimostrato che di primaria importanza è l’integrità della barriera intestinale.
La barriera intestinale, composta da cellule strettamente legate, assicura il trasferimento selettivo dei nutrienti e limita il movimento di organismi patogeni dal lume intestinale al sistema ospite. Il GM influenza l'integrità della barriera intestinale sia mantenendo i meccanismi di segnalazione immunitaria, sia producendo metaboliti come gli acidi grassi a catena corta (SCFA). Pertanto, i disturbi di uno di questi fattori possono portare ad un aumento della permeabilità intestinale. Ad esempio, la disbiosi intestinale nei casi di malattie infiammatorie o a causa di una dieta ad alto contenuto di grassi, di alcol e di antibiotici, può causare la perdita dell'integrità della barriera intestinale.
Una compromissione dell'integrità della barriera intestinale può portare alla traslocazione di microrganismi e di molecole prodotte dai microbi nel sistema portale. In queste condizioni, tali microbi e i loro metaboliti possono raggiungere il fegato, da dove possono raggiungere, attraverso il sistema portale, gli organi distali causando così infiammazione e lesioni (vedi Fig. 1).

La traslocazione dei metaboliti e dei modelli molecolari associati ai patogeni (PAMPs) biosintetizzati dai microbi nell'intestino, attraverso la circolazione portale, arriva al fegato, dove esercitano molteplici effetti sulle sue condizioni.
FXR: Farnesoid X Receptor, recettore per gli acidi biliari
TLR: Toll Like Receptor, recettore che attiva la risposta immunitaria
LPS: Lipopolisaccaridi
TMAO: Trimetilamina ossidata
SCFA: Acidi grassi a catena corta
GPCR: recettore per la proteina G, che causa inibizione della motilità intestinale
Origine: Anand S, Mande SS. Host-microbiome interactions: Gut-Liver axis and its connection with other organs. NPJ Biofilms Microbiomes. 2022 Nov 1;8(1):89. doi: 10.1038/s41522-022-00352-6. PMID: 36319663; PMCID: PMC9626460.
RUOLO DEL MICROBIOTA SU METABOLISMO E STATO DI SALUTE
I metaboliti biosintetizzati dal microbioma, e trasferiti dall'intestino attraverso la circolazione sistemica e portale, esercitano effetti multipli rivestendo un ruolo importante sull’insorgenza di malattie epatiche.
- Trimetilammina (TMA ) e ossido di trimetilammina (TMAO)
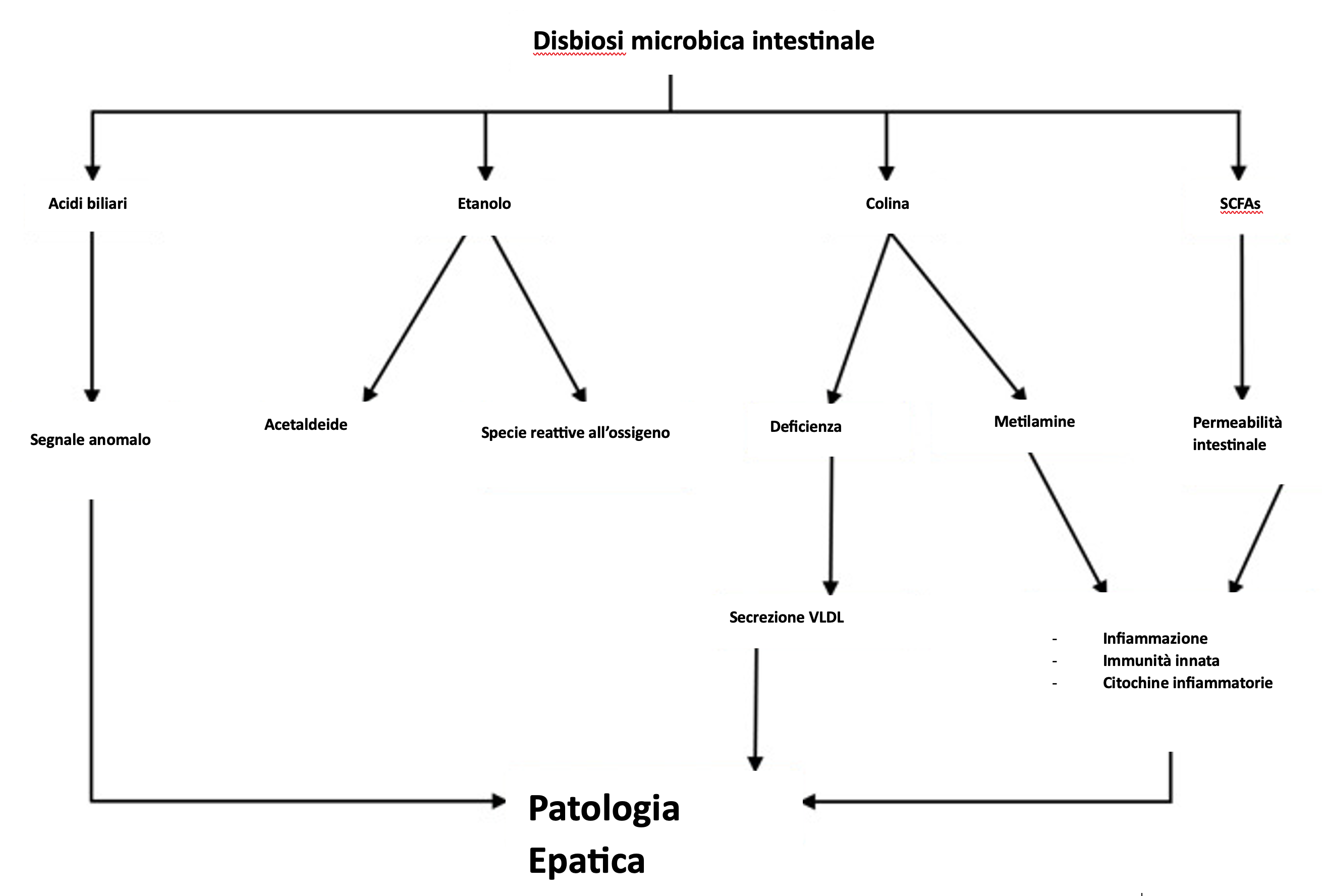
La colina, un macronutriente dietetico, è coinvolta in molteplici processi fisiologici nel fegato, che includono la biosintesi dei fosfolipidi (fosfatidilcolina e altri lipidi di membrana), il metabolismo del colesterolo e la circolazione enteroepatica di bile e lipidi. La minore disponibilità di colina conduce all'accumulo di trigliceridi (a causa della minore formazione di fosfatidilcolina da parte dell'ospite) nel fegato, un fattore associato alla NASH e anche alla manifestazione della NAFLD. Se una dieta povera di colina induce la steatoepatite, viceversa l'eccesso di colina viene trasformato in TMA dai microrganismi intestinali. La TMA così formata giunge al fegato attraverso la circolazione portale e viene convertita in TMAO, un componente che è stato implicato in molteplici disturbi cardiometabolici, malattie epatiche, etc. Pertanto, la carenza di colina nella dieta porta a un'alterazione della funzione epatica e cerebrale, nonché dei processi metabolici e della contrazione muscolare, il suo eccesso ugualmente arreca problemi cardiometabolici e danni epatici.
- Acidi grassi a catena corta (SCFA)
I metaboliti come gli SCFA includono principalmente butirrato, propionato e acetato e risultano dall'assimilazione con la dieta di polisaccaridi, amidi, fibre, etc. Gli SCFA rappresentano fonte di nutrimento ed energia per l'epitelio intestinale ed operano come precursori della lipogenesi e della gluconeogenesi. Il livello di butirrato nell'intestino contribuisce a mantenere l'integrità e la permeabilità intestinale. Una diminuzione del butirrato si osserva in diverse patologie epatiche e nelle lesioni epatiche influenzate dall'alcol.
Gli SCFA legano e attivano i recettori accoppiati a proteine G (GPCR). Questa attivazione influenza la secrezione di peptidi-YY e provoca l'inibizione della motilità intestinale. La segnalazione attraverso GPR41 e GPR43 porta alla secrezione di Peptide simil glucagone 1 (GLP1) che a sua volta riduce l'assunzione di cibo e lo svuotamento del tratto gastrico. Inoltre, la segnalazione dei GPCR influisce anche sulla regolazione dell'ossidazione degli acidi grassi e sulla sensibilità all'insulina da parte degli epatociti.
Oltre alla segnalazione basata sui GPCR, gli SCFA possono raggiungere il fegato attraverso la circolazione portale e possono avere effetti benefici o deleteri sul fegato. Ad esempio, l'aumento dell'acetato può essere convogliato verso la via di biosintesi degli acidi grassi, portando così all'accumulo di trigliceridi che è stato spesso correlato a disturbi epatici.
Queste differenze nel funzionamento complessivo degli SCFA nelle malattie del fegato possono essere influenzate da fattori come la dieta e l'ambiente.
- Etanolo e acetaldeide
L'etanolo viene assorbito principalmente nello stomaco e nell'intestino tenue attraverso la diffusione da parte della mucosa gastrointestinale. Alcuni microbi intestinali possono convertire l'etanolo in acetaldeide e, in misura minore, in acetato, utilizzando l'alcol deidrogenasi. Anche il fegato esprime enzimi per il metabolismo dell'etanolo in risposta al contenuto sistemico di esso.
È probabile che il consumo di etanolo si aggiunga alla fisiopatologia delle malattie epatiche (NASH, NAFLD, ecc.), poiché può non solo causare un aumento della permeabilità intestinale, ma anche contribuire alla produzione di citochine infiammatorie. L'etanolo endogeno può aumentare la disponibilità di acetato, un precursore della formazione di trigliceridi. L'ossidazione dell'etanolo da parte del citocromo CYP2E1 può portare alla produzione di radicali liberi, che aumentano l'infiammazione. Oltre a questo, l'etanolo può essere metabolizzato in acetaldeide, che può rompere le giunzioni strette dell'epitelio intestinale o avere un effetto citotossico e metabolico ossidante-dipendente sulle cellule intestinali di tipo goblet.
- Acidi biliari
L'ossidazione del colesterolo per formare gli acidi biliari primari, l'acido colico e l'acido chenodeossicolico (CDCA), avviene negli epatociti attraverso un processo a più fasi. Gli acidi biliari rilasciati entrano nei canalicoli attraverso una pompa di esportazione e si spostano verso la cistifellea, dove vengono immagazzinati per poi essere rilasciati nel duodeno al momento dell’assunzione di cibo, come risposta all'aumento della produzione di colecistochinina. Il microbioma intestinale converte questi acidi biliari primari in acidi biliari secondari, come gli acidi desossicolico, litocolico e ursodesossicolico.
L'acido chenodesossicolico contribuisce a regolare i livelli di glucosio e il metabolismo (aumenta la sensibilità all'insulina, la sintesi di glicogeno e inibisce i geni gluconeogenici), influenza anche il trasporto del colesterolo, inibisce la lipogenesi e migliora l'ossidazione degli acidi grassi. Gli acidi biliari determinano anche una riduzione dell'espressione dei geni lipogenici e contribuiscono a ridurre i livelli di trigliceridi. Mentre la maggior parte (95%) degli acidi biliari viene riassorbita nella parte distale dell'ileo e trasportata di nuovo al fegato attraverso la vena porta, la parte restante viene deconiugata dal microbioma intestinale ed escreta nelle feci. È probabile che una piccola frazione di acidi biliari riassorbiti sfugga all'assorbimento nel fegato e raggiunga i tessuti periferici attraverso la circolazione sistemica.
Origine: Anand S, Mande SS. Host-microbiome interactions: Gut-Liver axis and its connection with other organs. NPJ Biofilms Microbiomes. 2022 Nov 1;8(1):89. doi: 10.1038/s41522-022-00352-6. PMID: 36319663; PMCID: PMC9626460.
La sorveglianza immunitaria da parte del fegato influisce sugli organi distali.
Il fegato svolge un ruolo importante nell'immunomodulazione e possiede quasi l'80% di tutti i macrofagi tissutali. Influenza l'immunità innata in altri organi ed è responsabile della secrezione di mediatori dell'infiammazione, come l'IL-6 (Interleuchina 6) sierica e la proteina di fase acuta PCR.
Pertanto, è importante comprendere il ruolo del microbioma intestinale, i metaboliti biosintetizzati nel fegato e gli effetti complessivi sugli organi distali.
Vediamo ora i principali assi multiorgano dove il fegato svolge un ruolo cruciale.
- Asse intestino-fegato-cervello
Approfondiremo questo asse nella sua sezione specifica di questo portale, ma sinteticamente vi descriviamo l’esempio paradigmatico di interazione tra intestino fegato e cervello rappresentato dall'encefalopatia epatica (HE). L’HE mette in relazione la funzione cerebrale con le malattie epatiche comportando una vasta gamma di anomalie neurologiche e psichiatriche, che vanno dalle alterazioni subcliniche al coma. L'HE è stata spesso osservata come una delle principali complicazioni nei soggetti con insufficienza epatica, come la cirrosi epatica e la fibrosi. L'HE è osservata nel 30-45% dei pazienti con cirrosi epatica e nel 24-53% dei pazienti con shunt portosistemico intraepatico transgiugulare (TIPS).
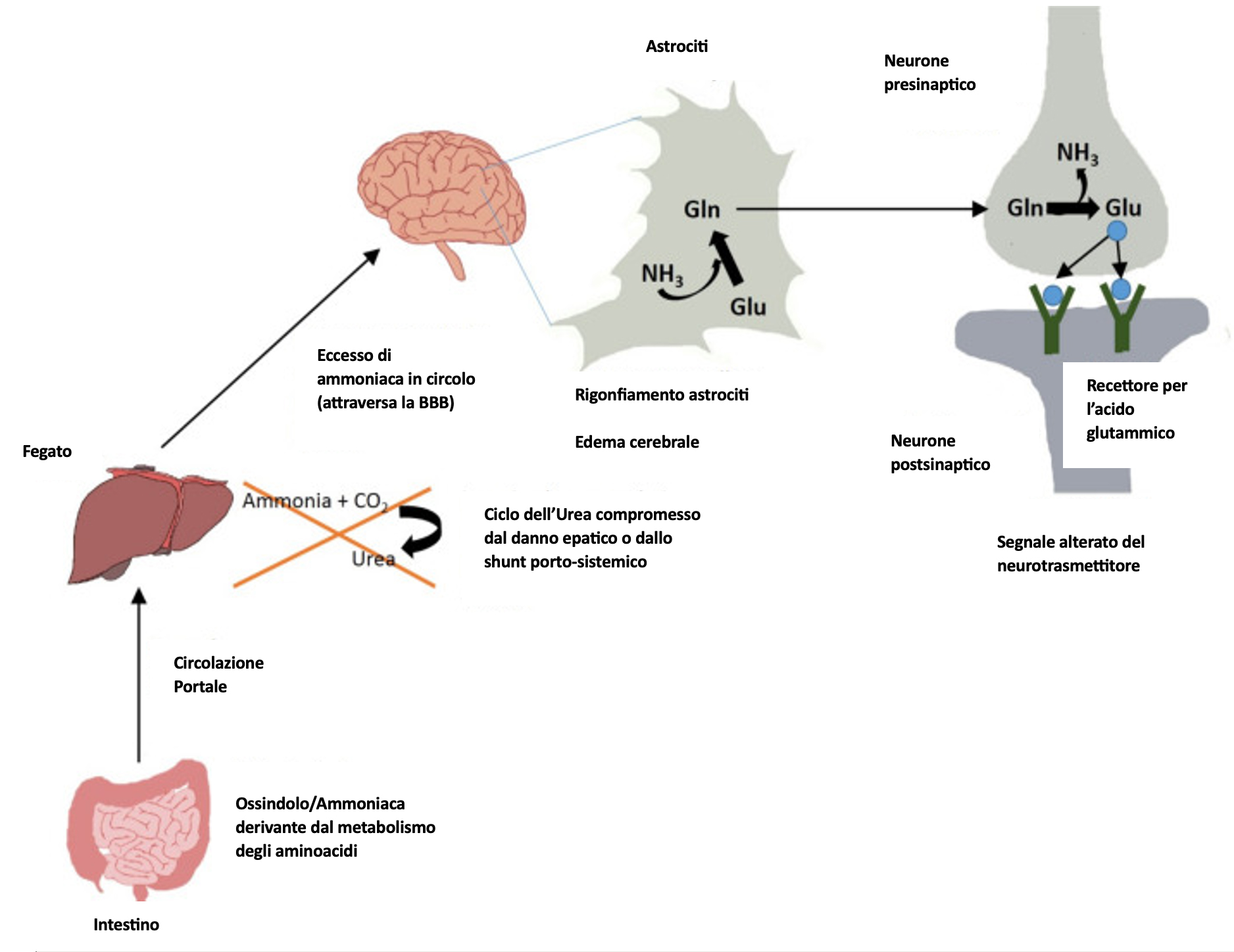
I prodotti microbici intestinali come l'ammoniaca e l'ossindolo, sono deleteri per il cervello. L'ossindolo agisce come sedativo, operando come legante per i canali del sodio azionati dalla differenza di potenziale elettrico nell’encefalo. L'ammoniaca influenza la neurotrasmissione, il pH, il potenziale di membrana, il rigonfiamento degli astrociti, etc. Le malattie epatiche come la cirrosi sono spesso associate a un'insufficienza nella detossificazione dell'ammoniaca e dei derivati dell'indolo da parte del fegato.
L'ammoniaca si forma principalmente nel tratto gastrointestinale, passa nella circolazione portale e raggiunge il fegato dove viene ulteriormente detossificata dal ciclo dell'urea. I soggetti con shunt portosistemico o insufficienza epatica hanno spesso capacità di detossificazione epatica compromesse che portano a un accumulo eccessivo di rifiuti azotati nel circolo sistemico (Fig.3). L'ammoniaca in eccesso può attraversare la barriera ematoencefalica (BBB) ed essere assorbita dagli astrociti, dove può essere convertita in glutammina che può causare stress ossidativo od osmotico e rigonfiamento degli astrociti stessi, edema cerebrale e aumento dell'attività GABAergica (Fig.3).
Altro fattore determinante è rappresentato dall'infiammazione sistemica, che può verificarsi in caso di cirrosi epatica a causa di molteplici componenti, uno dei quali è l'aumento della permeabilità intestinale che può portare alla traslocazione di batteri e dei loro prodotti nella circolazione sistemica.
Origine: Anand S, Mande SS. Host-microbiome interactions: Gut-Liver axis and its connection with other organs. NPJ Biofilms Microbiomes. 2022 Nov 1;8(1):89. doi: 10.1038/s41522-022-00352-6. PMID: 36319663; PMCID: PMC9626460.
- Asse intestino-fegato-rene
Il microbioma intestinale svolge un ruolo rilevante nella connessione tra fegato e reni. La disbiosi intestinale conduce ad un'elevata fermentazione delle proteine nell'intestino, dando luogo alla formazione di ammoniaca, indolo, p-cresolo, etc. Questi prodotti vengono assorbiti dalla mucosa intestinale e portati al fegato dove vengono ulteriormente modificati dalle solfotransferasi o dalle glucoronotransferasi dell'ospite per dare origine a indoxil-solfato, indoxil glucuronato, p-cresil-solfato e p-cresil-glucuronato, tutte tossine uremiche. Queste tossine raggiungono quindi il circolo sistemico e vengono eliminate attraverso la filtrazione renale. Tali tossine influenzano anche la progressione delle patologie renali e si osservano elevate nei pazienti con malattia renale allo stadio terminale (ESRD) (Fig. 4). Pertanto, la quantità di tossine uremiche presenti nell'organismo in caso di danno renale è influenzata anche dalle condizioni del fegato.
ASSE INTESTINO FEGATO RENE SENZA (a) E CON (b) DANNO EPATICO
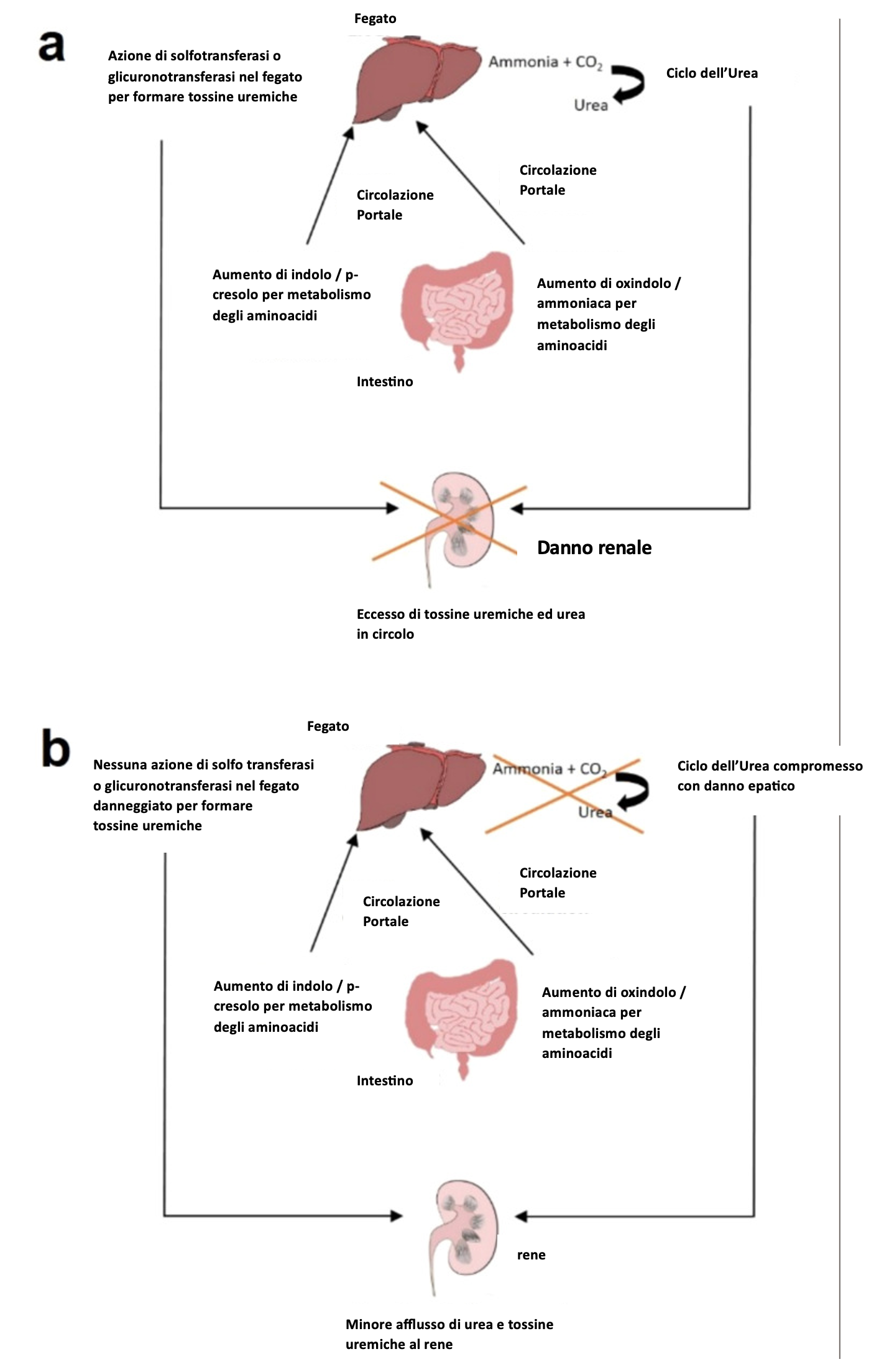
Fig.4 (b) Asse intestino-fegato-rene con danno epatico: L'ossindolo e il cresolo prodotti nell'intestino non vengono convertiti in tossine uremiche nel fegato.
Origine: Anand S, Mande SS. Host-microbiome interactions: Gut-Liver axis and its connection with other organs. NPJ Biofilms Microbiomes. 2022 Nov 1;8(1):89. doi: 10.1038/s41522-022-00352-6. PMID: 36319663; PMCID: PMC9626460.
- Asse intestino-fegato-polmoni
Un aumento dell'immunità innata concomitante a un aumento dei marcatori infiammatori come la proteina C-reattiva (CRP) è stato associato al deterioramento della funzione polmonare e all'esacerbazione di malattie come la broncopneumopatia cronica ostruttiva (BPCO). La prevalenza di steatosi, NASH e fibrosi nei pazienti con BPCO è stata riportata rispettivamente al 41,4%, 36,9% e 61,3%89. L'aumento della risposta immunitaria innata e dei marcatori pro-infiammatori come l'IL-6 sono stati correlati alla fisiopatologia dei disturbi polmonari. Il fegato è un sito di immunomodulazione e la via del mevalonato svolge un ruolo fondamentale. Si è osservato che le statine, che inibiscono la via del mevalonato nel fegato, riducono il danno polmonare. L’asse intestino fegato-polmoni collega la reattività immunitaria innata e il danno polmonare con la risposta immunitaria innata regolata dal fegato e dalla via del mevalonato.
Per valutare il possibile legame tra dieta e malattie respiratorie, i risultati di uno studio (Varraso 2010) su ~120.000 soggetti, hanno indicato una riduzione significativa dell'insorgenza di BPCO con l'assunzione di una dieta ad alto contenuto di fibre. Studi epidemiologici e clinici suggeriscono anche il ruolo delle diete ad alto contenuto di fibre nel ridurre l'infiammazione sistemica ed i marcatori dell'infiammazione come CRP e IL-6.
Uno dei possibili modi in cui le fibre alimentari apportano benefici è quello di stimolare la crescita di batteri benefici nell'intestino, che aiutano la biosintesi di acidi grassi a catena corta (SCFA) attraverso la fermentazione. Alcuni SCFA vengono assorbiti ed entrano nella circolazione portale, condizionando la funzionalità epatica. Gli SCFA influenzano la migrazione di neutrofili e macrofagi contribuendo a ridurre la risposta infiammatoria polmonare. Inoltre, gli SCFA inibiscono la HMG-CoA reduttasi, che catalizza la fase limitante della via del mevalonato. Questa inibizione consente di ridurre i marcatori infiammatori e di abbassare la risposta immunitaria innata.
- Asse intestino-fegato-cuore
Le malattie epatiche come la NAFLD, la NASH e la cirrosi, che sono state associate ad alterazioni del microbioma intestinale, sono anche correlate all'insorgenza di disturbi cardiovascolari (CV). La malattia del fegato grasso non alcolica (NAFLD) è associata a un rischio più elevato di malattie cardiovascolari (CVD), che comprendono malattie coronariche (CHD), insufficienza cardiaca, ictus e aritmie. L’alterazione del microbioma intestinale determina una risposta immunitaria infiammatoria con rilascio di citochine pro-infiammatorie. Questo processo promuove l'ossidazione delle LDL, la formazione di placche aterosclerotiche e la trombogenesi.
CONCLUDENDO
GM e fegato sono strettamente collegati. I metaboliti prodotti dal GM sono collegati al fegato attraverso la circolazione sistemica, la circolazione portale e il dotto biliare. I metaboliti prodotti nell'intestino influenzano l'immunità, il metabolismo e la produzione di acidi biliari. Gli acidi biliari prodotti nel fegato regolano a loro volta la composizione microbica intestinale e l'integrità della barriera epiteliale intestinale. Pertanto, una disbiosi intestinale non solo porta ad un cambiamento nel pool di acidi biliari all'interno dell'ospite, ma è spesso osservata anche in patologie correlate al fegato come NAFLD, MAFLD, NASH, ALD, etc. Inoltre, poiché alcuni batteri intestinali sono in grado di metabolizzare gli acidi biliari, il pool di acidi biliari determina e influenza la composizione del GM. Lo spostamento del livello di acidi biliari ha un impatto sull'integrità intestinale e sul metabolismo. L'esposizione delle cellule immunitarie del fegato a metaboliti come il TMAO prodotto dai batteri intestinali può aumentare l'infiammazione epatica. Inoltre, il fegato regola l'immunità innata e il metabolismo di varie tossine e metaboliti in altri organi. Il suo deterioramento ha pertanto un impatto sulla quasi totalità delle funzioni dell’organismo.
NOTE BIBLIOGRAFICEH
Giuffrè M, et al.
A story of liver and gut microbes: how does the intestinal flora affect liver disease? A review of the literature.
Am J Physiol Gastrointest Liver Physiol. 2020 May 1;318(5): G889-G906. doi: 10.1152/ajpgi.00161.2019. Epub 2020 Mar 9.Anand S, Mande SS.
Host-microbiome interactions: Gut-Liver axis and its connection with other organs.
NPJ Biofilms Microbiomes. 2022 Nov 1;8(1):89. doi: 10.1038/s41522-022-00352-6. PMID: 36319663; PMCID: PMC9626460.Suzuki, T.
Regulation of the intestinal barrier by nutrients: the role of tight junctions.
Anim. Sci. J.91, e13357 (2020)Rohr MW, et al.
Negative effects of a high-fat diet on intestinal permeability: a review.
Adv. Nutr. 2020;11:77–91Seki E, Schnabl B.
Role of innate immunity and the microbiota in liver fibrosis: crosstalk between the liver and gut.
J. Physiol. 2012;590:447–458Tripathi A, et al.
The gut-liver axis and the intersection with the microbiome.
Nat. Rev. Gastroenterol. Hepatol. 2018;15:397–411. doi: 10.1038/s41575-018-0011-zLombardi B, Ugazio G, Raick A.
Choline-deficiency fatty liver: relation of plasma phospholipids to liver triglycerides.
Am. J. Physiol. -Leg. Content. 1966;210:31–36. doi: 10.1152/ajplegacy.1966.210.1.31Janeiro, M. H., et al.
Implication of trimethylamine N-oxide (TMAO) in disease: potential biomarker or new therapeutic target.
Nutrients10, 1398 (2018)den Besten G, et al.
The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism.
J. Lipid Res. 2013;54:2325–2340. doi: 10.1194/jlr.R036012Silva, Y. P., Bernardi, A. & Frozza, R. L.
The role of short-chain fatty acids from gut microbiota in gut-brain communication.
Front. Endocrinol. 11, 25 (2020)Priyadarshini M, Kotlo KU, Dudeja PK, Layden BT.
Role of short chain fatty acid receptors in intestinal physiology and pathophysiology.
Compr. Physiol. 2018;8:1091–1115. doi: 10.1002/cphy.c170050Aragonès G, et al.
Gut Microbiota-Derived Mediators as Potential Markers in Nonalcoholic Fatty Liver Disease. BioMed Research International. 2019;2019:e8507583. doi: 10.1155/2019/8507583Bishehsari F, et al.
Alcohol and gut-derived inflammation.
Alcohol Res. Curr. Rev. 2017;38:163–171Elamin E, Masclee A, Troost F, Dekker J, Jonkers D.
Cytotoxicity and metabolic stress induced by acetaldehyde in human intestinal LS174T goblet-like cells.
Am. J. Physiol. Gastrointest. Liver Physiol. 2014;307:G286–G294. doi: 10.1152/ajpgi.00103.2014Chiang JYL. Bile acid metabolism and signaling.
Compr. Physiol. 2013;3:1191–1212. doi: 10.1002/cphy.c120023Prawitt J, Caron S, Staels B.
Bile acid metabolism and the pathogenesis of type 2 diabetes.
Curr. Diab. Rep. 2011;11:160–166. doi: 10.1007/s11892-011-0187-xNehring, S. M., Goyal, A. & Patel, B. C.
C Reactive Protein
StatPearls 2022Campion D, et al.
Dietary approach and gut microbiota modulation for chronic hepatic encephalopathy in cirrhosis. World J. Hepatol. 2019;11:489–512. doi: 10.4254/wjh.v11.i6.489Lin, C.-J. et al.
The role of liver in determining serum colon-derived uremic solutes.
PLoS ONE10, e0134590 (2015)Young RP, Hopkins RJ, Marsland B.
The gut-liver-lung axis. modulation of the innate immune response and its possible role in chronic obstructive pulmonary disease.
Am. J. Respir. Cell Mol. Biol. 2016;54:161–169. doi: 10.1165/rcmb.2015-0250PSViglino D, et al.
Nonalcoholic fatty liver disease in chronic obstructive pulmonary disease.
Eur. Respir. J. 2017;49:1601923. doi: 10.1183/13993003.01923-2016Hothersall E, McSharry C, Thomson NC.
Potential therapeutic role for statins in respiratory disease.
Thorax. 2006;61:729–734. doi: 10.1136/thx.2005.057976Varraso R, et al.
Alternate Healthy Eating Index 2010 and risk of chronic obstructive pulmonary disease among US women and men: prospective study.
BMJ. 2015;350:h286. doi: 10.1136/bmj.h286North CJ, Venter CS, Jerling JC.
The effects of dietary fibre on C-reactive protein, an inflammation marker predicting cardiovascular disease.
Eur. J. Clin. Nutr. 2009;63:921–933. doi: 10.1038/ejcn.2009.8Ismaiel, A. & Dumitraşcu, D. L.
Cardiovascular risk in fatty liver disease: the liver-heart axis—literature review.
Front. Med. 6, 202 (2019)Przybyszewski EM, Targher G, Roden M, Corey KE.
Nonalcoholic fatty liver disease and cardiovascular disease.
Clin. Liver Dis. 2021;17:19–22. doi: 10.1002/cld.1017



